HER2陽性の乳がん治療
HER2陽性乳がんとは
HER2陽性乳がん(HER2-positive breast cancer)は、乳がんのサブタイプの一つで、がん細胞が「ヒト上皮成長因子受容体2」(HER2)というタンパク質を過剰に発現していることが特徴です。HER2は細胞の成長や分裂に関与するタンパク質で、通常は体内の細胞表面に存在し、正常な細胞成長を調節します。しかし、HER2が過剰に発現している場合、がん細胞が制御不能に増殖し、より攻撃的な性質を持つ乳がんとなります。
HER2陽性乳がんは、乳がん全体の約15~20%を占めており、他のサブタイプに比べて増殖が早く、転移のリスクも高いとされています。ただし、現在ではHER2に対する効果的な標的療法が開発されており、治療成績は劇的に改善されました。これにより、かつて予後不良とされていたHER2陽性乳がんも、適切な治療により良好な予後を得られることが多くなっています。
HER2陽性乳がんの診断
HER2陽性乳がんの診断には、がん組織に対して特定の検査が行われます。通常、以下の2つの方法が用いられます:
- 免疫組織化学染色法(IHC)
この方法では、HER2タンパク質の発現レベルを測定します。結果はスコア(0、1+、2+、3+)で表され、3+の場合はHER2陽性と診断されます。スコア2+の場合は、曖昧な結果とされ、さらにFISH検査が行われます。 - 蛍光 in situ ハイブリダイゼーション(FISH)
FISH検査は、HER2遺伝子の増幅の有無を確認するための検査です。この検査でHER2遺伝子が増幅している場合、HER2陽性と診断されます。FISH検査は、IHC結果が不明確な場合に特に有用です。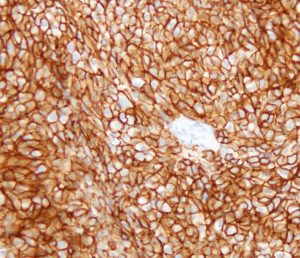
HER2 陽性乳がんの組織像(免疫染色)
HER2陽性乳がんの治療法
HER2陽性乳がんの治療には、HER2を標的とした治療が不可欠です。以下に、主要な治療法を説明します。
1. HER2標的療法
HER2陽性乳がんに対する治療の中心は、HER2タンパク質を標的とする分子標的薬です。これにより、がん細胞の成長と増殖が抑制されます。主なHER2標的薬は以下の通りです:
- トラスツズマブ(商品名:ハーセプチン)
トラスツズマブは、HER2受容体に結合してその機能を阻害する抗体医薬品です。1998年に承認されて以来、HER2陽性乳がんの治療に大きな進展をもたらしました。トラスツズマブは、がん細胞の増殖を抑え、免疫系によるがん細胞の破壊を促進します。手術後の補助療法(術後補助療法)として使用されることが一般的で、化学療法と併用されることが多いです。 - ペルツズマブ(商品名:パージェタ)
ペルツズマブは、HER2の異なる部位に結合する抗体医薬品で、トラスツズマブと併用されることが多いです。ペルツズマブはHER2の二量体化(細胞膜上での結合)を阻止し、がん細胞の増殖を一層抑制します。術前治療や進行・再発したHER2陽性乳がんに対して使われることが一般的です。 - T-DM1(商品名:カドサイラ)
T-DM1は、トラスツズマブに抗がん剤(エムタンシン)が結合した薬剤で、HER2陽性の進行乳がんや再発乳がんの治療に用いられます。この薬はHER2陽性がん細胞に選択的に抗がん剤を届けることができ、がん細胞に対して高い殺傷効果を発揮します。 - ラパチニブ(商品名:タイケルブ)
ラパチニブは、HER2受容体の内側のチロシンキナーゼ領域に結合し、がん細胞内の信号伝達を阻害する小分子チロシンキナーゼ阻害薬です。トラスツズマブやペルツズマブとは異なり、内服薬として使用され、通常は他の治療に耐性を示した進行・転移性乳がんに対して使用されます。
2. 化学療法
HER2陽性乳がんでは、HER2標的療法に加えて化学療法も併用されることが一般的です。化学療法は、がん細胞の分裂や成長を阻害する薬剤を使用し、がんの増殖を抑える治療法です。術前(ネオアジュバント療法)や術後(アジュバント療法)の補助療法として、また進行乳がんに対して使用されます。ドセタキセルやカルボプラチンなどの薬剤がよく使われます。
3. 放射線療法
手術後に放射線療法が行われることもあります。特に、乳房温存術を受けた患者では、再発リスクを下げるために乳房全体やリンパ節に対して放射線を照射します。HER2陽性乳がんの場合、再発リスクが高いため、放射線療法が併用されることが多いです。
4. ホルモン療法
HER2陽性乳がんの一部にはエストロゲン受容体(ER)やプロゲステロン受容体(PR)も陽性であるケースがあります。これらのホルモン受容体陽性のがんには、ホルモン療法が効果的です。ホルモン療法は、がん細胞の成長を促進するエストロゲンの作用を阻害する治療法です。タモキシフェンやアロマターゼ阻害薬などが一般的に使用されます。
HER2陽性乳がんの治療効果と予後
HER2陽性乳がんは、HER2タンパク質の過剰発現によって進行が早く、治療しない場合の予後は他のサブタイプよりも悪いとされています。しかし、HER2を標的とした治療が確立されて以来、予後は劇的に改善されました。特に、トラスツズマブの登場によって、術後補助療法や進行乳がんに対する治療成績は大きく向上しました。
早期HER2陽性乳がんの場合、適切な治療を受けることで、再発リスクは大幅に低減され、長期的な生存率も高くなります。術後の補助療法としてトラスツズマブを1年間投与するのが標準的な治療法であり、これによって再発率が半減することが報告されています。
進行・再発HER2陽性乳がんの場合でも、HER2標的療法の進歩によって治療効果が向上し、生存期間の延長が期待できます。特にペルツズマブやT-DM1の併用によって、従来の化学療法単独よりも優れた治療成績が得られています。
HER2陽性乳がんにおける治療の課題
HER2陽性乳がんの治療成績は向上しているものの、いくつかの課題も残されています。一部の患者では、HER2標的薬に対して耐性が生じることがあり、再発や進行がみられる場合があります。HER2陽性乳がん治療の課題については以下にまとめます。
HER2陽性乳がんにおける治療の課題について
HER2陽性乳がんの治療は、過去数十年で劇的に進展し、トラスツズマブ(ハーセプチン)をはじめとするHER2を標的とした薬剤により、生存率や再発リスクが大幅に改善されました。しかしながら、依然としていくつかの課題が残されています。以下に、HER2陽性乳がん治療の今後の主要な課題を挙げて解説します。
1. 治療耐性の問題
HER2陽性乳がんに対する分子標的薬は大きな効果を示しますが、一部の患者ではこれらの薬剤に対する耐性が生じることがあります。特に、トラスツズマブやペルツズマブの治療においては、時間が経つにつれて効果が低下し、がんが再発・進行することが確認されています。この耐性の発生メカニズムは完全には解明されていないものの、がん細胞がHER2に依存しない経路を利用して増殖することや、HER2の発現が変化することが一因と考えられています。
解決策の方向性:耐性に対応するため、HER2を標的にした治療薬の新たな組み合わせや、HER2以外の分子経路(PI3K/AKT/mTOR経路など)を同時に阻害する新薬が開発されています。また、T-DM1(カドサイラ)のような抗体薬物複合体(ADC)は、HER2陽性がん細胞に直接毒性を持つ薬剤を届け、耐性克服に寄与していますが、さらに新しいADCや免疫療法の研究が進んでいます。
2. 薬剤の副作用
HER2陽性乳がんに対する治療薬は非常に効果的ですが、薬剤による副作用の問題が依然として課題です。特にトラスツズマブは、心臓毒性(心不全や心筋機能の低下)を引き起こすことがあるため、治療中および治療後も定期的に心機能を監視する必要があります。また、化学療法と併用する場合、骨髄抑制や疲労感、消化器系の問題などの副作用も患者にとって負担となります。
解決策の方向性:薬剤の副作用を軽減するため、新しい薬剤や投与方法が研究されています。たとえば、経口薬や皮下投与の薬剤が開発され、より便利で副作用の少ない治療法が模索されています。また、副作用の予防や軽減を目的とした補助療法も進化しており、心機能保護薬の使用なども検討されています。
3. 個別化医療の推進
HER2陽性乳がん患者の全員が同じ治療に同じように反応するわけではありません。がん細胞の遺伝的背景や個々の患者の体質によって、治療効果や副作用の発現が異なるため、より個別化された治療が求められています。現在、HER2に対する標的療法が広く適用されていますが、治療効果を最大化するためには、各患者に最適な治療法を見極めることが必要です。
解決策の方向性:遺伝子解析やバイオマーカーを活用して、治療の効果や耐性のリスクを予測する「個別化医療」の研究が進んでいます。がんの遺伝子プロファイリングに基づいて、HER2標的療法に加え、他の分子標的薬や免疫療法を組み合わせる治療法が開発されており、より効果的かつ安全な治療法が期待されています。
4. 再発リスクの管理
HER2陽性乳がんは標的療法によって再発リスクが低減されましたが、一部の患者では治療終了後も再発の可能性が残ります。特に、進行期の患者やがんが多くのリンパ節に転移していた場合、治療後も再発リスクが高いことが知られています。再発した場合、治療選択肢は限定され、治療効果も限られることが多いため、再発予防は重要な課題です。
解決策の方向性:再発リスクをより正確に予測し、長期的なフォローアップが必要です。また、再発リスクが高い患者に対しては、治療期間を延長することで再発リスクをさらに低減できるかどうかが研究されています。現在、標的療法の使用期間に関する研究が進められており、治療の延長や中断の最適なタイミングが検討されています。
5. 治療費とアクセスの問題
HER2陽性乳がんに対する標的治療薬は非常に高価であり、患者や医療システムにとって大きな経済的負担となります。特に、先進国と比べて医療資源が限られている地域では、トラスツズマブやペルツズマブといった最新の治療法にアクセスすることが難しい状況です。これにより、治療の不平等が生じることが懸念されています。
解決策の方向性:治療費の軽減とアクセス向上のため、バイオシミラー(生物学的製剤の同等品)の開発が進んでいます。トラスツズマブのバイオシミラーはすでに市場に出ており、費用負担の軽減が期待されています。また、国際的な支援プログラムや製薬会社による支援を通じて、低所得国でも最新の治療にアクセスできるような取り組みが求められています。
6. 新しい治療法の開発
現在のHER2陽性乳がんの治療は、トラスツズマブやペルツズマブ、T-DM1などが中心ですが、今後の治療法のさらなる進化が期待されています。特に免疫療法や新しい抗体薬物複合体、さらにはHER2以外の分子経路を標的とした薬剤の開発が進んでいます。
解決策の方向性:免疫療法は、患者自身の免疫システムを活性化してがんを攻撃する治療法で、HER2陽性乳がんにおいても臨床試験が進行中です。また、HER2以外の分子を標的とする薬剤や、複数の分子経路を同時に抑制する新しい治療法が開発されています。これにより、さらに効果的かつ耐性を克服できる治療が期待されています。
まとめ
HER2陽性乳がん治療は、標的療法の導入によって大きな進歩を遂げましたが、依然として治療耐性や副作用、個別化医療の実現、再発リスクの管理、治療費やアクセスの問題といった課題が残されています。これらの課題を克服するためには、新しい治療法の開発と個別化治療のさらなる進展が必要です。引き続き、研究と臨床試験が進められ、HER2陽性乳がん患者にとってより効果的で安全な治療法が提供されることが期待されています。
———————————————-
HER2陽性乳がん

HER2 陽性乳がん(免疫染色) 強い全周性の染色が細胞膜に認められる
HER2 (human epidermal growth factor receptor 2) は乳がんの進展に関わる糖タンパクで、細胞表面に存在します。病理レポートには必ずHER2の結果が記載されており、HER2が個別の患者さんの乳がんにおいて重要な役割を担っているかどうかを知ることができます。乳がんに関わるこのタンパクの発現とそれに対応する遺伝子の増幅状況を知ることにより、乳がんがどのように振る舞い、特定の薬剤にどのように反応するか予想することが可能となります。
20年以上前にトラスツズマブが臨床導入されたことで(1998年FDAが認可、2001年日本で認可)、HER2陽性乳がん患者の予後は劇的に改善されました。特に早期乳がんについては予後が大きく改善され、大部分の症例に対して化学療法と抗HER2療法の併用が実施されています。抗HER2療法を2剤用いる併用療法(dual-HER2 blockade)は、リンパ節転移陽性例の予後を改善することが示され、トラスツズマブとペルツズマブの併用療法が行われています。また術前化学療法において浸潤癌が遺残し場合はT-DM1を追加することの効果がKATHERINE試験で示され、現在の標準治療となっています。一方治療のデ・エスカレーション(減量)も重要なテーマで、早期がんあるいは高齢者にはより副作用の少ないパクリタキセルとトラスツズマブの併用療法が用いられています。(下記は明らかな遠隔転移:6㎝の肝転移にも関わらず、化学療法+抗HER2療法で完治したと考えられる当院のケースで、HER2陽性乳がんではこのような事例が決して稀でないことが知られています)

ルミナルHER2タイプの乳癌 この方は6㎝の肝転移を認めたがゼローダ+ハーセプチン(化学療法+抗HER2療法)のみで腫瘍は完全消失し、その後15年経過した現在も再燃なく健康に暮らしておられます。
HER2陽性乳がんの最新動向について(進行再発乳がん治療 )
HER2陽性乳がんの領域では2020年に4つの新薬がアメリカFDAに承認されるなど、大きな進歩を遂げています。
1987年にHER2受容体が注目された当初、HER2受容体は、他の乳がんのサブタイプと比較して、予後が最も悪いとされていました。現在では、トラスツズマブに続き、ラパチニブ、ペルツズマブ、アド・トラスツズマブ・エムタンシン(T-DM1)、ネラチニブが登場したことで、HER2陽性乳がんの予後はかなり良好なものとなっています。
術後補助療法で化学療法にトラスツズマブを追加することで、全生存率が37%相対的に改善し、10年生存率は75.2%から84%に上昇しました。同様の効果は、転移性の治療においても認められています。2020年、FDAはHER2陽性乳がんに対する4つの新しいHER2治療薬(トラスツズマブ デルクステカン (DS-8201)、ツカチニブ、ネラチニブ、マルゲツキシマブ)を承認しました。
トラスツズマブ・デルクステカン(DS-8201:商品名エンハーツ)は、新規の抗HER2薬の中では最も有望であり、新しいカテゴリーのHER2低値の乳がんにも、使えるようになるかもしれないと期待されています。 ツカチニブとネラチニブは、HER2-陽性乳がんで脳神経系に転移した患者のための、最新かつ有望な治療薬です。免疫療法と CDK4/6 阻害剤は、 HER2 陽性乳がんの治療への導入は遅れましたが、今後は使用されていくと期待されています。
トラスツズマブ デルクステカン (日本で認可済み)
トラスツズマブ デルクステカンは、HER2を標的とするトラスツズマブと細胞障害性のトポイソメラーゼ阻害薬のデルクステカンを結合させた抗体薬物複合体です。HER2 陽性の再発・転移性乳がん患者への二次治療を対象としたトラスツズマブ デルクステカンの第3相臨床試験(DESTINY-Breast03)の中間解析において、主要評価項目が達成されたと発表されました。この試験は、トラスツズマブとタキサン系薬剤による前治療を受けたHER2陽性の再発・転移性乳がん患者約500名を対象としたグローバル第3相臨床試験であり、本剤投与群がT-DM1(トラスツズマブ エムタンシン)に対し、統計学的に有意かつ臨床的意義のある改善を示したと結論付けられました。
マルゲツキシマブ(日本で未認可)
トラスツズマブと同じHER2エピトープ(エピトープは、抗原決定基とも呼ばれ、免疫系によって認識される抗原の一部である)に対する新規の抗体であるが、トラスツズマブとの違いは、ナチュラルキラー細胞やマクロファージに存在するCD16A Fc受容体への親和性が向上していることと、トラスツズマブに比べて抑制性のCD32B受容体への親和性が低下していることである。この設計は、自然免疫の強化を目的としています。
2020年12月16日、米国食品医薬品局(FDA)は、化学療法と併用するマルゲツキシマブを、2種類以上の抗HER2レジメンの前治療を受け、そのうち少なくとも1種類が転移性疾患に対する治療であった転移性HER2陽性乳がんの治療薬として承認しました。根拠となったSOPHIA試験は無作為化臨床試験で、患者は、マルゲツキシマブと化学療法を併用する群と、トラスツズマブと化学療法を併用する群に割り付けられました。統計的には有意であったものの、PFSの改善が少なかったことから、本試験は現時点では標準治療を変えるものではないとされています。
ネラチニブ(日本で未認可)
ネラチニブは不可逆的な汎HER(HER1、HER2、HER4)チロシンキナーゼ阻害剤で、初期の試験ではカペシタビンとの併用で有効性を示し、特に中枢神経系の転移に対する治療に有効であることが示されました。これを受けてNALA試験が開始されました。NALA試験は、過去にHER2をターゲットにした転移性乳がんレジメンで少なくとも2回治療を受けた、HER2陽性の転移性乳がん患者を対象に、ネラチニブ+カペシタビンと、可逆的デュアルTKIであるラパチニブ+カペシタビンを比較する、無作為化第III相試験でした。この結果が有意だったため、neratinibは2020年2月にFDAより、2種類以上の抗HER2ベースのレジメンを受けたことのある進行・転移性のHER2陽性乳がん患者の治療薬として、カペシタビンとの併用で承認されました。
ツカチニブ(日本で未認可)
強力かつ選択的なATP競合型の経口投与可能なHER2阻害剤であり、in vitroではEGFRに対してHER2に対して約500倍の選択性がある。これにより、ネラチニブのような特異性の低いHER2 TKIよりも良好な毒性プロファイルが得られることが期待された。ONT-380とも呼ばれる本剤は、HER2+乳がんにおけるトラスツズマブ抵抗性に関連すると考えられている切断型HER2(p110/p95)のリン酸化も有意に阻害する。
第III相HER2CLIMB試験(トラスツズマブ+カペシタビン±ツカチニブの比較)が実施されました。脳転移のある患者では、1年後の進行のない生存率は、ツカチニブ併用群で24.9%、プラセボ併用群で0%であった。
これらの素晴らしいデータの結果、2020年4月、アメリカFDAは、脳転移を有する患者を含む、切除不能または転移性の進行したHER2陽性乳がんで、転移期に1つ以上の抗HER2ベースのレジメンを投与された患者を対象に、トラスツズマブおよびカペシタビンとツカチニブの併用療法を承認しました。
HER2陽性乳がんに対する術前療法について
手術可能なHER2陽性乳がんを対象とした術前療法の初期研究では、化学療法にトラスツズマブ(商品名:ハーセプチン)を追加することでpCR率(がんが顕微鏡レベルで消失する割合)が有意に上昇することが示されました。 その後、HER2を標的とした治療法を単独または化学療法と組み合わせて評価した結果、化学療法との併用が依然として重要であることが示され、HER2を標的とした治療法と化学療法の併用で最も高いpCR率が得られました。
HER2療法が標準治療として取り入れられるようになると、アントラサイクリン系薬剤の必要性が疑問視されるようになりました。 さらに、低リスクのHER2陽性乳がん患者に対する治療強度を落とす戦略や、術前療法後に残存病変がある患者に対する補助療法の追加についても評価しています。
HER2陽性・転移性乳がんの治療(その2)
はじめに
ヒト上皮成長因子受容体2(HER2)陽性の乳がんは従来、全身転移や脳転移のリスクが高く、全生存率が低いとされてきました。トラスツズマブ(商品名ハーセプチン:2001年日本で承認)の導入により、HER2陽性の患者さんの治療成績は劇的に改善し、多くの患者さんがルミナルタイプ(ホルモン受容体陽性・HER2陰性)の患者さんと同様の治療成績を示すようになりました。現在、HER2陽性の転移性乳がん患者さんの第一選択の標準治療は、ペルツズマブ/トラスツズマブとタキサン系薬剤の併用によるHER2抗体療法です。この治療が効かなくなった場合はトラスツズマブ・エムタンシン(T-DM1)が標準治療(セカンドライン:2014年4月日本で承認)となります。さらに進行した場合はより限られたものになりますが、最近、米国食品医薬品局から承認されたツカチニブ(日本で未承認)やトラスツズマブ・デルクステカン(2020年5月に日本で承認)など、有望な新薬が有効な選択肢として登場しています。
一次治療 ペルツズマブ/トラスツズマブ/ドセタキセル(又は パクリタキセル)
二次治療 T-DM1(商品名カドサイラ)
三次治療 トラスツズマブ・デルクステカン(商品名エンハーツ)など
抗HER2薬の登場により、この20年間でHER2陽性乳がんの治療パラダイムは大きく変化し、多くの薬剤の開発により、これまでにない生存率の向上が実現しました。モノクローナル抗体、チロシンキナーゼ阻害剤(TKI)、抗体薬物複合体(ADC)は、現在、HER2陽性転移性乳がん(MBC)の治療の骨格になっています。
トラスツズマブ、ペルツズマブ、タキサン系抗がん剤によるファーストライン治療
2000年代初頭、トラスツズマブと化学療法の併用により、HER2陽性の転移性乳がん患者の無増悪生存期間と全生存期間が有意に改善された。日本では2001年4月承認にこの薬剤は承認されています。トラスツズマブは、HER2の細胞外ドメインのサブドメインIVに結合し、細胞内シグナル伝達経路を活性化するホモ二量化を阻害し、細胞の増殖と生存を阻止します。トラスツズマブの追加に伴う最も重大な毒性は心機能障害です。なお、アントラサイクリン系抗がん剤とトラスツズマブの併用療法では、心機能障害の発生率が高かったため、ACとトラスツズマブの併用療法は中止され、転移性の治療においては、アントラサイクリン系以外の単剤化学療法と抗HER2療法の併用療法が広く採用されています。
第二世代の抗HER2抗体であるペルツズマブ(商品名;パージェタ)は、HER2の膜貫通型受容体のサブドメインIIに結合します。 クレオパトラ試験では、トラスツズマブとタキサン系抗がん剤にペルツズマブを追加投与することが検討されました。ペルツズマブの追加により、16.3カ月の全生存期間の延長が認められました。ペルツズマブの副作用は比較的許容できるものでしたが、下痢,発疹,頭痛,筋痙攣の発生率は,トラスツズマブ単独群よりも高いことが示されています。 これらのデータにより、HER2陽性の転移性患者において、トラスツズマブ、ペルツズマブ、タキサン系薬剤を用いた標準的な第一選択治療が確立されました。
チロシンキナーゼ阻害剤(TKI)
TKIは、細胞内で作用し、伝達カスケードを停止させることで細胞の成長を阻害する、もう一つのクラスの抗HER2薬です。現在、米国食品医薬品局(FDA)は、HER2陽性のMBCの治療薬として、ラパチニブ、ネラチニブ、ツカチニブの3つのTKIを承認しています。(日本ではラパチニブのみが承認されています)。
ネラチニブ
ネラチニブは、不可逆的な汎 HER 阻害剤(HER1、HER2、HER4)であり、当初は EXTENET 試験の結果に基づいて FDA から術後補助療法として承認されました。最近、FDAはNALA試験の結果に基づいて、転移性治療のサードラインの治療薬(ペシタビン+ネラチニブの併用)としてネラチニブの使用を承認しました。
ツカチニブ
ツカチニブ(日本では未承認)は、HER2 のキナーゼドメインに高い選択性を持ち、EGFR の阻害を最小限に抑えることができる新しい TKI です。In vitro試験では、ツカチニブのHER2に対する選択性がEGFRの約500倍であることが示されており、その良好な毒性プロファイルを説明しています。さらに、分子サイズが小さいため、脳血液関門を通過しやすく、中枢神経系(CNS)の疾患に直接作用することができます。
HER2CLIMB試験は、トラスツズマブ、ペルツズマブ、トラスツズマブ T-DM1による前治療歴のある患者の3次治療として、トラスツズマブおよびカペシタビンとtucatinibの併用を評価した第3相試験です。患者は、トラスツズマブとカペシタビンを併用して、ツカチニブまたはプラセボを投与するよう無作為に割り付けられた。注目すべきは活動性があり治療を受けた脳転移を有する患者が試験に含まれ(両群で約45%)、専ら局所療法後に進行した後に治療を継続することが認められました。この試験では、カペシタビン+ツカチニブ+トラスツズマブの併用療法は、脳転移を含む重度の前治療を受けた患者において、OSが4カ月間増加するという素晴らしい結果が得られ、非常に有効な選択肢であることが示唆されました。この結果を受けて、FDAは、転移性疾患で1つ以上の抗HER2薬ベースのレジメンを受けたことのある進行性HER2陽性疾患患者の治療薬として承認しました。
抗体薬物複合体(ADC)
ADCは、特定の標的抗体と結合することにより、細胞傷害性化学療法を腫瘍細胞に直接投与する新しいクラスの抗がん剤です。
T-DM1
T-DM1は、トラスツズマブと、細胞障害性薬剤であるDM1(エムタンシン:強力な微小管阻害剤)とを、切断不可能なリンカーを介して共有結合させたもので、トラスツズマブの抗腫瘍活性を維持したまま、DM1を腫瘍細胞に送り込むことを目的としています。第3相EMILIA試験8では、トラスツズマブとタキサン系抗がん剤による前治療歴のあるHER2陽性乳がん患者の二次治療として、T-DM1とラパチニブおよびカペシタビンを比較しました。T-DM1は、ラパチニブとカペシタビンの併用療法と比較して、PFSの中央値を改善し、35%の患者で死亡または病勢進行の可能性を減少させました。
別の第3相試験であるTH3RESA試験でも、トラスツズマブとラパチニブを含む2種類の抗HER2療法を受けたことのあるHER2陽性乳がん患者において、医師が選択した治療法と比較して、T-DM1によるPFSおよびOSの改善が示されています。これらの知見により、T-DM1は、トラスツズマブとタキサン系薬剤の投与を受けたことのある患者の二次治療および三次治療としてFDAに承認されました。
MARIANNE試験では、T-DM1が治療歴のない患者の良い選択肢であることを証明できませんでした。本試験では、トラスツズマブとタキサン系薬剤を併用する群(第1群)、T-DM1とプラセボを併用する群(第2群)、T-DM1とペルツズマブを併用する群(第3群)に患者を無作為に割り付けましが、これら各群にPFSにおいて有意な差を認めませんでした。これらのデータに基づき、T-DM1は、トラスツズマブとペルツズマブによる二重ブロック療法に加え、タキサン系薬剤による治療で進行したHER2陽性患者の標準的な二次治療と考えられます。
トラスツズマブ・デラクステカン(商品名エンハーツ、日本の第一三共が開発した薬剤)は、HER2を特異的に阻害するヒト化モノクローナル抗体に、切断可能なリンカーを介してトポイソメラーゼI阻害剤を結合させたもので、T-DM1と比較して薬物対抗体比が8倍になっている。興味深いことに、血漿中に遊離した状態では高い安定性を示すが、腫瘍細胞表面に過剰に発現している酵素によって容易に切断されてしまうという組成になっている。トラスツズマブ・デルクテカンは、細胞膜透過性が高いため、HER2の発現レベルが低い細胞に対しても活性を示し、この細胞毒性要素が細胞膜を通過して、HER2の発現レベルにかかわらず近隣の細胞に直接作用する、バイスタンダー効果と呼ばれる現象が見られる。
DESTINY-Breast01試験は、T-DM1で進行した後のHER2陽性MBC患者に対するトラスツズマブ・デルクステカンのFDA承認につながった、重要な多施設共同非盲検第2相試験です。脳疾患の活動性または未治療の患者は除外されました。全身治療の前歴の中央値は6(範囲、2~27)で、すべての患者がトラスツズマブとT-DM1の投与を受けたことがあり、65%がペルツズマブの投与を受けたことがありました。トラスツズマブ・デルクステカンの投与を受けた184名の患者では、60.9%の奏効率が認められました(完全奏効が6%、部分奏効が54.9%)。また、病勢コントロール率は97.3%と素晴らしい結果でした。消化器系および血液系の有害事象が最も一般的で管理可能な有害事象でしたが、ILDの発生率が高いことが確認されました(13.6%[0.5%グレード4])。ILDの潜在的なリスクを考慮すると、トラスツズマブ・デルクステカンの投与を受けているすべての患者には慎重なモニタリングが推奨され、グレード2以上の毒性が認められた人には薬剤の中止が推奨されます。
特別な条件
脳への転移
HER2陽性のMBC患者の治療が大きく進歩したにもかかわらず、30%から55%の患者にCNS転移が見られます。このような状況下では、血液脳関門を通過する新薬の開発と、活動性CNS転移患者を含む臨床試験のデザインが、依然として重要です。
ツカチニブは、 HER2 陽性 MBC の活動性脳転移に対する最新の治療戦略です。
また、ネラチニブは脳転移にも活性を示しています。NALA 試験の患者6のうち、 16% が無症候性または安定した CNS 脳転移 (治療済みまたは未治療) を有しており、 ネラチニブ群では CNS 転移に新たな介入を必要とする患者が少なかったのです。
抗体医薬の中枢神経系への浸透は限られていると思われるが、T-DM1に関する最近のデータでは、脳転移に対する活性が示されています。
HER2陽性/エストロゲン受容体陽性の腫瘍
HER2陽性乳がんの約50%は、ホルモン受容体も発現している。前臨床試験では、乳がんにおけるHER2とエストロゲン受容体(ER)のシグナル伝達経路のクロストークが、ホルモン療法への抵抗性に寄与することが示唆されている。臨床試験では、トラスツズマブとタモキシフェンまたはフルベストラントを併用することで、これらのホルモン剤に対する腫瘍の感受性が回復することが確認されている。ELECTRAおよびTANDEMの第3相試験では、トラスツズマブとアロマターゼ阻害剤の併用は残念な結果となりましたが、抗HER2療法とアロマターゼ阻害剤の二重療法の併用は、より満足のいく生存率の向上が得られるようです。
HER2陽性乳がんと免疫チェックポイント阻害薬
PD-1/PD-L1 を標的とした免疫チェックポイント阻害剤は、化学療法との併用により、PD-L1 陽性のトリプルネガティブ乳癌患者において臨床効果が認められています。前臨床データでは、HER2陽性の腫瘍は免疫力が高く、トラスツズマブは腫瘍に対する免疫反応を高めることが示されています。HER2陽性腫瘍では、腫瘍浸潤リンパ球の発生率が高いだけでなく、PD-L1の発現量も多いことが一貫したデータで示されており、両者は良好な転帰と相関しています。しかし、抗PD-L1剤とHER2ブロックを併用した場合のデータはまだ少ないのが現状です。
まとめ
過去30年においてHER2陽性の転移性乳がんの治療は大きな進歩を遂げました。この膜タンパク質の過剰発現は、当初は予後不良のバイオマーカーとして認識されていましたが、現在では標的となる分子変化と認められており、その治療薬によって患者さんの予後とQOLが大幅に改善しています。ツカチニブやトラスツズマブ・デルクステカンなど、効果の高い薬剤の登場により、治療の順序付けが(いい意味で)難しくなってきており、患者さんごとに最適な治療法を決定するためには、有用なバイオマーカーを特定することも重要になっています。
(参考文献)
Evolving concepts in HER2 evaluation in breast cancer: Heterogeneity, HER2-low carcinomas and beyond. Marchiò C et al Semin Cancer Biol. 2021 Jul;72:123-135.
HER2-positive metastatic breast cancer: a comprehensive review. Exman P et al Clin Adv Hematol Oncol. 2021 Jan;19(1):40-50.
HER2-positive breast cancer and tyrosine kinase inhibitors: the time is now. Schlam I et al NPJ Breast Cancer. 2021 May 20;7(1):56. doi: 10.1038/s41523-021-00265-1.
Treatment strategies for breast cancer brain metastases. Bailleux C et al Br J Cancer. 2021 Jan;124(1):142-155.
New therapeutic strategies in HER2-positive breast cancer Mery B et al Bull Cancer. 2021 Jun 15:S0007-4551(21)00215-0.
The changing treatment of metastatic her2-positive breast cancer. Mitsogianni M et al Oncol Lett. 2021 Apr;21(4):287

The Okura Tokyo at Toranomon Aug. 2021
