トリプルネガティブ乳がん
トリプルネガティブ乳がんの特徴と治療法
1. トリプルネガティブ乳がんの概要
トリプルネガティブ乳がん(Triple Negative Breast Cancer: TNBC)は、乳がんの中でも特に治療が困難なタイプの一つです。乳がんには様々な亜型が存在し、それぞれのがん細胞は異なる生物学的特徴を持っています。その中でも、TNBCはホルモン受容体(エストロゲン受容体、プロゲステロン受容体)とHER2(ヒト上皮成長因子受容体2)という三つの主要な分子マーカーが陰性であるため、他の乳がんと比べて治療選択肢が限られるのが特徴です。
ホルモン療法やHER2を標的とした治療が効かないため、化学療法が治療の主軸となるケースが多いです。トリプルネガティブ乳がんは全体の乳がん症例の約10~20%を占め、特に若年層やアフリカ系アメリカ人女性に多く見られます。加えて、進行が早く、再発リスクが高いという特徴があり、他のタイプの乳がんと比べて予後が悪いことが知られています。
2. トリプルネガティブ乳がんの生物学的特徴
トリプルネガティブ乳がんの特性は、ホルモン受容体やHER2に依存しないことに起因しています。具体的には、以下の三つの受容体が陰性であるという点で診断されます。
- エストロゲン受容体陰性:エストロゲンによる増殖シグナルがトリガーされないため、ホルモン療法の効果が期待できません。
- プロゲステロン受容体陰性:プロゲステロンががん細胞の増殖に関与しないため、こちらもホルモン療法の対象外となります。
- HER2陰性:HER2は、細胞の増殖や生存に関わる受容体ですが、これが陰性であるため、HER2を標的とする薬剤(トラスツズマブなど)は効果がありません。
これらの特徴により、TNBCは一般的に他の乳がんと比べて治療が難しく、化学療法に頼らざるを得ない場合が多くなります。また、遺伝子レベルでの特徴として、BRCA1やBRCA2遺伝子に変異がある場合が多いことも知られており、この場合は特に若年層に発症する傾向があります。BRCA変異はDNA修復機構に影響を与え、がんの発生リスクを高める要因となります。
3. トリプルネガティブ乳がんの治療法
トリプルネガティブ乳がんの治療は、他のタイプの乳がんと異なり、ホルモン療法やHER2標的治療が使えないため、主に化学療法が中心となります。ここでは、主要な治療法について詳述します。
a. 化学療法
化学療法は、TNBCに対する主要な治療法の一つです。特に、手術前に行う術前化学療法(ネオアジュバント療法)は、腫瘍を縮小させ、手術をより効果的に行うために使用されます。手術後には、術後化学療法(アジュバント療法)として再発リスクを低減させるためにも用いられます。使用される薬剤は以下のようなものが一般的です。
- アントラサイクリン系薬剤(ドキソルビシンなど):がん細胞のDNAを破壊し、増殖を抑える薬剤です。
- タキサン系薬剤(パクリタキセル、ドセタキセルなど):細胞分裂を阻害し、がん細胞の増殖を止めます。
- プラチナ系薬剤(シスプラチン、カルボプラチンなど):特にBRCA1/2遺伝子変異を有するTNBC患者に効果的とされ、DNAの修復を阻害してがん細胞を死滅させます。
これらの化学療法は、腫瘍の縮小や進行抑制に効果的ですが、副作用も強く、治療中の生活の質が低下することも少なくありません。
b. 免疫療法
近年、TNBCに対する治療として免疫療法が注目されています。特に、PD-1/PD-L1阻害薬と呼ばれる免疫チェックポイント阻害剤が効果を示しています。これらの薬剤は、がん細胞が免疫系から逃れるために使うメカニズムを妨害し、免疫系ががん細胞を認識して攻撃するように働きかけます。
代表的な薬剤には、**アテゾリズマブ(商品名:テセントリク)やペムブロリズマブ(商品名:キイトルーダ)**があります。これらの薬剤は、特にPD-L1陽性のTNBC患者に効果があるとされており、化学療法と併用されることが多いです。
c. PARP阻害薬
PARP(ポリADPリボースポリメラーゼ)は、DNA修復に関わる酵素です。TNBC患者の中でも、特にBRCA1/2遺伝子に変異がある患者に対しては、PARP阻害薬が有効とされています。PARP阻害薬は、がん細胞のDNA修復を阻害し、がん細胞を死滅させる働きがあります。
代表的なPARP阻害薬には、**オラパリブ(商品名:リムパーザ)やタラゾパリブ(商品名:タラゼンカ)**があります。これらの薬剤は、遺伝子変異を持つTNBC患者に対しては有望な治療選択肢となっています。
d. 新たな治療法と臨床試験
TNBCは新しい治療法が求められている領域であり、現在も様々な臨床試験が進行中です。その中で注目されているのが、抗体薬物複合体(ADC)や新しい免疫療法薬です。
- 抗体薬物複合体(ADC):抗体に化学療法薬を結合させた薬剤で、がん細胞を特異的に攻撃することが可能です。現在、いくつかのADCがTNBCに対して臨床試験中です。
- 新しい免疫療法薬:従来の免疫チェックポイント阻害薬に加え、新しい免疫療法薬の開発も進んでいます。これにより、免疫系がより効果的にがん細胞を排除する可能性が期待されています。
4. トリプルネガティブ乳がんの予後と生活の質
トリプルネガティブ乳がんの予後は他のタイプの乳がんに比べて厳しいことが多いですが、早期発見や適切な治療により、生存率を向上させることは可能です。特に、術前化学療法で完全寛解が得られた場合、予後が良好となるケースもあります。
一方で、TNBC患者は治療の過程で身体的・精神的な負担が大きく、生活の質(Quality of Life: QOL)が低下しがちです。治療中は副作用への対策や心理的サポートが重要であり、家族や医療スタッフとの連携も必要です。
5. まとめ
トリプルネガティブ乳がんは、治療の選択肢が限られ、予後が悪いタイプの乳がんですが、近年の免疫療法やPARP阻害薬などの新しい治療法の登場により、治療成績の改善が期待されています。依然として多くの課題が残る一方で、臨床試験や新薬の開発が進むことで、今後の治療法がさらに多様化し、患者のQOL向上につながることが期待されます。
——————————————
トリプルネガティブ乳がんの生物学的特徴
**トリプルネガティブ乳がん(Triple-Negative Breast Cancer: TNBC)**は、乳がんの一形態で、エストロゲン受容体(ER)、プロゲステロン受容体(PR)、およびヒト上皮成長因子受容体2型(HER2)の発現がいずれも陰性であることから「トリプルネガティブ」と呼ばれます。この3つの受容体は、他のタイプの乳がんでは治療ーゲットとして使用されることが多いのですが、TNBCではこれらの標的がないため、治療の選択肢が限られていることが特徴です。TNBCは全乳がんの約15%を占め、のタ他の乳がんサブタイプと比べて予後が不良であり、再発や転移のリスクが高いことが知られています。
1. 分子生物学的特徴
TNBCの最も顕著な特徴は、ホルモン受容体(ER、PR)およびHER2がいずれも陰性であることです。このため、ホルモン療法やHER2に対する標的治療が効果的でないという問題があります。TNBCは異質性が高く、分子生物学的にはいくつかのサブタイプに分類されます。代表的なサブタイプとしては、基底様(Basal-like)TNBCが挙げられます。基底様TNBCは、基底細胞に関連する遺伝子(例えば、細胞骨格タンパク質であるケラチン5やケラチン6)を高発現することが特徴です。
基底様TNBCは、全TNBCの約70-80%を占め、分子レベルで他の乳がんとは異なる特徴を持っています。基底様TNBCは、通常高い細胞増殖能を示し、Ki-67という増殖指標も高値を示します。さらに、p53遺伝子の変異が高頻度で認められ、DNA修復機構に関与するBRCA1遺伝子の欠失や変異がある場合も多いです。これらの遺伝子変異は、細胞の分裂や増殖の異常を引き起こし、がんの進展に寄与すると考えられています。
2. 悪性度と進行の速さ
TNBCは他の乳がんサブタイプと比較して悪性度が高く、進行が速いとされています。特に、再発や遠隔転移のリスクが高いことが大きな問題です。TNBC患者は、診断後の最初の2〜3年間に再発や転移が集中する傾向がありますが、その後の5年間の生存率は比較的安定します。このため、早期に治療を行うことが極めて重要です。
再発リスクが高い理由の一つに、腫瘍の浸潤性があります。TNBCの腫瘍は、周囲の正常組織への浸潤性が強く、リンパ節や血管に侵入して転移する能力が高いことが示されています。特に、肺や脳、肝臓などへの転移が多く見られます。これらの遠隔転移は、治療が困難であり、予後を大きく悪化させる要因となります。
3. 遺伝的特徴とBRCA1/2遺伝子
TNBCの発症には遺伝的要因が関与している場合が多く、特にBRCA1/2遺伝子の変異が強く関連しています。BRCA1遺伝子に変異を持つ患者は、TNBCを発症するリスクが高く、全体の15〜20%を占めるとされています。BRCA1遺伝子変異を持つTNBC患者は、PARP阻害剤という特定の化学療法に対して感受性が高いことが知られており、これが治療の一つの選択肢となっています。
BRCA1はDNA修復に関与する重要な遺伝子であり、これが変異するとDNA損傷が修復されず、がんの発生リスクが高まります。特に、BRCA1変異によるTNBCは、若年女性に多く見られ、侵襲性が強く、予後も悪い傾向があります。このように、BRCA1/2遺伝子変異は、TNBCの発症リスクだけでなく、治療選択にも影響を与える重要な因子となっています。
4. 免疫微小環境と免疫療法の可能性
TNBCは、他の乳がんサブタイプと比較して、免疫系との相互作用が強いことが知られています。具体的には、TNBC腫瘍の周囲には、腫瘍浸潤リンパ球(Tumor-Infiltrating Lymphocytes: TILs)が多く見られます。これらのTILsは、腫瘍に対する自然免疫応答を示しており、免疫療法が効果的に働く可能性が示唆されています。
免疫療法の一つであるPD-1/PD-L1阻害薬は、最近の臨床試験でTNBCに対して一定の効果を示しており、特に進行性のTNBC患者において有望な治療法とされています。PD-L1は、がん細胞が免疫系からの攻撃を回避するために使用するタンパク質であり、この経路を遮断することで免疫系が腫瘍を攻撃しやすくなります。PD-1/PD-L1阻害薬は、再発性または転移性のTNBCに対して効果を示しており、今後の治療の選択肢として期待されています。
5. 治療選択肢の限界と新たなアプローチ
TNBCはホルモン療法やHER2に対する標的治療が利用できないため、主な治療は化学療法に依存しています。しかし、化学療法に対する反応が良好である一方で、化学療法後の再発リスクが高いため、より効果的な治療法の開発が求められています。
最近の研究では、分子標的薬や免疫療法、**抗体薬物複合体(ADC)**などの新たな治療法が開発されています。例えば、ADCの一つであるサシツズマブ・ゴビテカンは、TNBCに対する有望な治療薬として注目されています。この薬剤は、がん細胞に結合する抗体と化学療法薬を結合させたもので、がん細胞に直接薬剤を届けることで副作用を最小限に抑えつつ効果を高めることが期待されています。
また、PARP阻害薬やDNA修復機構を標的とした治療も、特にBRCA1/2変異を有する患者に対して有効とされています。これらの新たな治療アプローチは、今後のTNBC治療の進展に寄与することが期待されています。
まとめ
トリプルネガティブ乳がんは、エストロゲン受容体、プロゲステロン受容体、HER2が陰性であることから治療選択肢が限られ、再発や転移のリスクが高い乳がんサブタイプです。特に、基底様サブタイプやBRCA1/2遺伝子変異が関与するケースが多く、進行が速く予後不良であることが特徴です。現在、化学療法が主な治療法となっていますが、免疫療法や分子標的薬など新しい治療アプローチが開発されており、今後の治療の可能性が期待されています。
以上、2024年10月
——————————————-
<トリプルネガティブ乳がんに関連するニュース>
EA1131試験の意義について(ECOG-ACRIN EA1131)
術前化学療法後にトリプルネガティブ乳がん(TNBC)が残存する患者を対象としたプラチナベースの化学療法とカペシタビンの術後無作為化第III相試験 J Clin Oncol. 2021 Aug 10;39(23):2539-2551
【結論】 プラチナ系製剤(カルボプラチン)は、BasalサブタイプのTNBCが術前化学療法後に遺残した患者の転帰を改善せず、カペシタビンと比較してより重篤な毒性を伴うことが明らかになった。
【意義・解釈について】BasalサブタイプのTNBCにプラチナ系製剤が有効であるとの前臨床モデルの結果からこの研究は行われたが、プラチナ製剤はカペシタビンの成績を改善することなく、毒性のみが有意に強く、その使用は勧められないと結論付けた(カペシタビンが標準治療)。
<早期トリプルネガティブ乳がんの治療のまとめ>
1)腫瘍の大きさが2㎝以上あるトリプルネガティブ乳がんには術前化学療法を(第一選択として)考慮する。
2)大多数の患者さんにはアントラサイクリン系とタキサン系の逐次レジメンが推奨される。
3)術前化学療法において週1回のナブパクリタキセルがパクリタキセルに代わる可能性がある。
4)術前化学療法においてプラチナ製剤(通常はカルボプラチン)の追加が考慮される。
5)アントラサイクリンが適合しない患者さんに対しては、カルボプラチン+ドセタキセルが代替レジメントして考慮される。
6)標準的な術前化学療法でpCR(病理的な腫瘍の消失)が得られないハイリスクの患者さんには、術後にカペシタビンを6~8サイクル追加することが考慮される。
7)近い将来、デュルバルマブ、アテゾリズマブ、ペムブロリズマブなどの免疫療法剤を術前療法として考慮する必要がある。
8)TILが30%以上のステージ1乳癌のような特殊な症例では、レトロスペクティブのデータをもとに化学療法を省略することも考慮される。
9)Luminal androgenサブタイプに対する抗アンドロゲン剤、BRCA1/2病的変異例に対するPARP阻害剤を用いた新しい臨床試験が必要である。
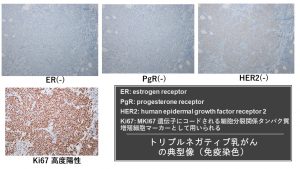
トリプルネガティブ乳がんの免疫染色パターン ER(-) PgR(-) HER2(-) 高Ki67
初めに
トリプルネガティブ乳がんはエストロゲン受容体(ER)、プロゲステロン受容体(PgR)、HER2蛋白の過剰発現をいずれも認めないがんのことです。これらはがんの増殖がホルモン(エストロゲン、プロゲステロン)やHER2蛋白に依存していないことを示しています。そしてトリプルネガティブ乳がんはホルモン剤、HER2蛋白受容体をターゲットにした薬剤には効果がありません。トリプルネガティブ乳がんは乳がん全体の15%程度を占めています(日本)。
トリプルネガティブ乳がんとは?
細胞の受容体は細胞内や、細胞表面にある特殊な蛋白であり、これらの受容体蛋白は細胞のいわば目や耳に相当するものです。正常の乳腺細胞の内部や表面にあるホルモン受容体はエストロゲンやプロゲステロンなどのホルモンから情報を受け取ります。ホルモンから見ると、これらは細胞にある受容体と結合し、細胞が増殖などの機能を果たす指令を提供することになります。70%程度の乳がんがホルモン受容体が陽性であり、ホルモンが増殖に関与しています。
一方で、15%くらいの乳がんにおいてHER2蛋白が過剰発現しています。正常の乳腺細胞においては、HER2は細胞の増殖を刺激する働きがあります。乳がん細胞においてHER2蛋白が過剰にある時は、細胞は非常に早く増殖し、分裂することになります。ホルモンの働きやHER2を標的にした治療(標的療法)では、エストロゲン、プロゲステロン、HER2蛋白の効果を減弱させ、乳がん細胞の増殖を遅らせ、停止させます。
トリプルネガティブ乳がんの特徴
トリプルネガティブ乳がんのは他の乳がんに比較してよりアグレッシブで、予後不良であり、これらはトリプルネガティブ乳がんを標的とする治療薬が少ないことが関与しています。トリプルネガティブ乳がんは転移を起こす確率、再発する確率が他の乳がんより高いことが知られています。
トリプルネガティブ乳がんはがんのグレードが高く、多くはグレード3です。また多くがベーサル様細胞(これは乳管の基底膜細胞様という意味)と言われており、ベーサルタイプ乳がんは進行が早く、より悪性度が高い乳がんです。ベーサルタイプの乳がんの多くが、トリプルネガティブ乳がんで、またトリプルネガティブ乳がんの多くがベーサルタイプという関係になっています。
どういう人がトリプルネガティブ乳がんに罹る傾向があるか?
誰でも罹る可能性はありますが、以下のような特徴があります。
1) 若い方~50歳以下の方
2) 黒人、ヒスパニック系の方~アジア人は比較的少ないとされています
3) BRCA1遺伝子に変異がある方(遺伝性乳癌卵巣癌)
トリプルネガティブ乳がんと診断された場合
乳がんの中でもより悪性度が高く、治療標的(ホルモン受容体、HER2蛋白)が限られていると告げられるとより衝撃は大きいと思います。しかしながら冷静にこの二つの標的が欠けている(ホルモン受容体とHER2蛋白)だけだというように、冷静に捉える必要があります。病期(ステージ)やがんのグレードも一方で重要な要素になります。また、ホルモン療法と抗HER2療法以外にもいくつかの治療法があることを理解しておくことが重要です。
トリプルネガティブ乳がんの治療について
トリプルネガティブ乳がんの治療は通常、手術、放射線治療、抗がん剤治療で行われます。がん剤治療は、しばしば手術の前に行われます(数か月間の外来治療)。抗がん剤が先に行われ、手術の結果がんの組織が完全に消失する場合が30~50%に見られ(pCRという言い方をされます)、このような効果が得られた場合は完治できる可能性が高いと期待できます。
PARP inhibitors(商品名リムパーザなど)
HER2蛋白の過剰発現がなく、遺伝性乳がん(BRCA1またはBRCA2に病的変異あり)の場合はこの系統の薬剤が期待できます(相同組換え修復関連遺伝子変異を有する患者さんに効果が期待できると表現されます)。
免疫療法(商品名テセントリックなど)
免疫療法(テセントリック:アテゾリズマブ)が進行再発乳がんでPD-L1陽性のトリプルネガティブ乳がんに適応となっています。テセントリックは化学療法薬であるアブラキサンと併用して用いられます。
免疫チェックポイント阻害剤であるこの薬剤は、がんが免疫システムを回避するのを助けるPD-L1蛋白を標的にした薬剤です。PD-L1を阻害することでテセントリックは免疫システムががん細胞を見出し、排除することを可能にする薬剤です。
トリプルネガティブ乳がん(TNBC)
乳がんの約10%〜15%を占めるTNBCは、依然として最も悪性度の高いサブタイプであり、一部の患者の早期の再発を特徴としている。ホルモン受容体陽性乳がんやHER2陽性の乳がんと異なり、明らかな標的治療がないため、TNBCはしばしば臨床的に治療が困難となる。 TNBCは細胞分裂が速く、ゲノムが不安定な高悪性度の腫瘍という特徴があり、化学療法のみの治療で、病理学的完全奏効(pCR)率が30%から40%に達する。しかしながらpCR率が高いにもかかわらず、TNBC患者の再発リスクは全体ではかなり高いという特徴を認めるた。DNA修復メカニズム、PI3K / mTOR阻害、アンドロゲン枯渇など、多くの分子経路が創薬に応用される可能性があるとして探究されている。最近、TNBC患者に2つの分子標的薬剤、即ちPARP阻害剤(オラパリブ)と免疫チェックポイント阻害剤(アテゾリズマブ)が利用可能になっているが、これらは現時点では進行再発例への適応にとどまっている。
トリプルネガティブ乳がんの術前療法後に腫瘍が遺残した場合、カペシタビン(ゼローダ)を追加するべきである
トリプルネガティブの患者さん、特に手術前に化学療法を行ったにもかかわらず残存病変がある患者さんは再発のリスクが高く、追加治療が必要かどうかは多くの治療医の悩みでした。
数年前、CREATE-X試験(日本・韓国)の結果が示されたとき多くの専門家は驚きました。ホルモン受容体陽性またはトリプルネガティブの患者さんに関わらず腫瘍が術前化学療法によって遺残した場合、ゼローダを追加することで再発率が低下することが有意に示されたからです。この結果は当初懐疑的にみられていましたが、その後に発表された2つの欧米での研究により、追加のゼローダの有効性が示され現在はこのゼローダの追加がトリプルネガティブ乳がんにおいて推奨されるようになりました。次もこれに関する話題(データ)です。

<トリプルネガティブ乳がんの分子生物学的な分類と治療法の進歩の展望> 以下は作成中
トリプルネガティブ乳がん治療の展望(2020年)
他の乳がんサブタイプと比較して、トリプルネガティブ乳がん(TNBC)の患者は、病期に関わらず予後が不良と考えられている。しかしながらこの数年で多くの画期的なゲノムおよび分子生物学的な発見があり、TNBCの生物学的な複雑さの理解を劇的に改善させる可能性が出てきた。ゲノム分析に基づくと、TNBCは多種多様な分子生物学的な異常を有する多様性のあるがんグループを構成していることが明らかになってきた。そしてそのような新しいターゲットに対して向けられた、多くの革新的な治療法を使用した新世代の臨床試験のためのプラットフォームを提供することになった。現在、2つのPARP阻害剤と1つの抗PD-L1モノクローナル抗体(化学療法との併用)が転移性TNBC患者の特定のサブグループで承認されており、この疾患も個別化医療の時代になってきた。TNBCのゲノムの全景を探索し、多くの実用的なターゲットについて議論したいと考える。また、主要な臨床を変えることになる臨床試験の結果、および転移性TNBC患者のための今後臨床導入される可能性がある個別化治療オプションについても議論していきたい。
他の乳がんサブタイプと比べて、TNBCは侵襲性が高く、早期の再発リスクが高い。患者はしばしば術後5年以内に再発し、その後の予後も不良である。 ER、PR、HER2の発現が陰性であるため、TNBCは内分泌療法および標的療法への反応が乏しい。非常に限られた治療レジメンのみがTNBCで利用可能であり、また有効性が低く、新しい治療法の開発が早急に必要である。
LAR(ルミナル・アンドロゲン受容体)サブタイプのTNBCはAR発現が陽性ですが、TNBCにおけるARのメカニズムと臨床的意義はまだ議論の余地があり、ARがTNBCの予後指標として使用できるかどうかについては、さらに検討する必要があります。 LARサブタイプの遺伝子変異の量が多く、主にPI3Kシグナル伝達遺伝子のPIK3CA、CDH1、PTEN、およびTP53遺伝子の遺伝子変異であることは注目に値します。したがって、PI3Kシグナル伝達経路をターゲットにすると、LARサブタイプTNBCの新しい治療標的になる可能性があります。
Mサブタイプ(間葉系サブタイプ)のTNBCサンプルにはPDGFRの高い発現がありますが、このサブタイプは対応する標的療法に感受性がありません。 MサブタイプTNBCが薬剤耐性を引き起こす他の調節メカニズムを持っているかどうかは、深く理解できていない。 MSL(mesenchymal stem-like)サブタイプは、血管新生関連の受容体PDGFRおよびVEGFRを過剰発現するため、抗血管新生療法を受けやすくなる可能性があります。免疫関連マーカーと免疫チェックポイント阻害遺伝子の高発現は、IM (immunomodulatory)サブタイプと他のTNBCサブタイプの主な違いです。したがって、IMサブタイプは、免疫チェックポイント阻害剤による治療の恩恵を受ける可能性があります。
MSL以外のすべてのTNBCサブタイプは、MYC遺伝子増幅の頻度が高く、BL1 (basal-like 1)およびMサブタイプも対応するmRNAの過剰発現を示します。 CDK1 / 2と制限酵素のコアコンポーネントBUD31の選択的阻害は、MYCを過剰発現するTNBC腫瘍細胞のアポトーシスを誘発する可能性があり、TNBC、特にBL1とMサブタイプは、CDK1 / 2と制限酵素阻害剤による治療の恩恵を受ける可能性があることを示唆しています。
さらに、異なる標的化治療法は、異なるTNBCサブタイプおよび異常な遺伝子コピー数を持つタイプの変異に基づいて開発することが可能です。たとえば、BL1サブタイプはゲノムの不安定性が高く、TP53、BRCA1 / 2、およびRB1遺伝子の欠損とPPAR1遺伝子の増幅があるため、BL1サブタイプはPARP阻害剤に感受性がある可能性があります。 RB1、CDK4、およびCDK6の発現レベルは、CDK4 / 6阻害剤の感度に関連しています。 CDK4およびCDK6 mRNAの発現は低いがRB1の発現が高いLARおよびMSLサブタイプは、CDK4 / 6阻害剤に感受性がある可能性があります。
BLIA (basal-like immune-activated)とBLIS (basal-like immunosuppressed)は、予後が逆のTNBCサブタイプです。 BLISが最も予後不良ですが、BLIAはLAR、MES、およびBLISよりも予後が良好です。この違いは、TNBC腫瘍細胞における免疫シグナルの発現と薬剤耐性および予後との間の相関を示唆しているものと思われる。 BLIAタイプでは、NK細胞経路、B細胞受容体経路、DC経路、T細胞受容体シグナル経路、IL-12およびIL-7経路など、免疫細胞に関連するシグナル伝達経路が優位に増強されており、またSTAT、CTLA4、CXCL9、IDO1、CXCL11、RARRES1、GBP5、CXCL10 / 13の発現レベルも増加している。CXCL10は創薬可能ゲノムに属しているため、医薬品のターゲットになると期待されています。さらに、STAT阻害剤、サイトカインまたはサイトカイン受容体抗体、およびイピリムマブ(最近FDA承認のCTLA4阻害剤)が、BLIAサブタイプTNBCの治療に使用される可能性があります。 BLISタイプでは、ほとんどすべての免疫細胞シグナル伝達経路が抑制されていますが、ELF5、HOHMAD1、FOXC1、VTCN1、SOX6、およびSOX10遺伝子の発現レベルは優位に上昇しています。 PD-1またはVTCN1抗体は標的免疫チェックポイント治療に使用できると予想されています。 4つの異なるサブタイプ、LAR、MES、BLIA、およびBLISからのTNBC患者サンプルのDNAおよびmRNA発現データの統合分析は、CDK1が4つのTNBCサブタイプすべてで増幅されたことを示しました(BLIAサブタイプが最も高い発現を示しました)。したがって、CDK1はTNBC治療標的となる可能性があります。
同時に、TNBCサブタイプの改良により、古い薬の新しい使用はTNBCの有効性を改善するための重要な研究の方向性を示した。臨床試験の結果は、BL1およびBL2 TNBC患者はMSLおよびARサブタイプよりもタキサンの臨床的な奏効率が高いことを示しています。これらの薬剤をアントラサイクリンと組み合わせると、TNBCのBL1サブタイプの患者はより高いpCR率を達成できます。さらに、BL1サブタイプTNBCの患者はプラチナ薬に対してより感受性がある。タキサン、アントラサイクリン、およびプラチナ薬と組み合わせた療法によりBL1 TNBC患者は、より優れた臨床効果を得る可能性があることが示唆されています。もちろん、特定の薬物選択と投与法は、検証するためにより多くの臨床試験結果を必要とします。私たちはさまざまな種類の化学療法薬と抗体薬を分類し、それらがTNBCサブタイプに適していると推測しました。
新しい治療レジメンとして、免疫療法のさまざまなTNBCサブタイプへの効果は不明で、前臨床的な研究データが必要である。PD1 / PDL-1をターゲットとするTNBC免疫療法では、新しい標的抗体の研究開発に加えて、末梢血単核細胞に由来する腫瘍関連マクロファージ(TAM)がTNBC微小環境に動員されることが明らかにされてきています。抑制性サイトカインを分泌することにより、腫瘍浸潤リンパ球の機能的影響が弱まり、制御性T細胞が増加して腫瘍の成長と発達を促進します。興味深いことに、TAMは腫瘍環境でPD-1とPD-L1の発現を同時にアップレギュレートできます。したがって、TAMをターゲットにしてPD1 / PDL-1ターゲティング薬の有効性を改善することは、実現可能な新しいアイデアかもしれません。さらに、関連するCAR-T免疫細胞療法のターゲットの変更とそのような療法の安全性評価は、より多くの臨床データによって明らかにされる必要があります。
TNBCを内因性の様々な分子サブタイプと免疫学的多様性を持つ疾患として理解し、さまざまな臨床表現型(フェノタイプ)を認識する最近の進歩がありました。この新しいシナリオでは、よりターゲットを絞った効果的な治療のために、免疫分子シグネチャを組み込んだ早急な包括的サブ分類が必要です。対象となる標的阻害剤とチェックポイント阻害剤が最近いくつかの設定に組み込まれていますが、細胞毒性化学療法は依然としてTNBCに対する基幹の療法であり、同様の臨床病理学的特徴を持つ患者に異なった結果をもたらしている。
免疫組織化学的分子サブタイプのより完全なアクセス可能なパネルは、TNBCの治療における決定を改善しました。さらに、多くの場合、化学療法の生存と反応を予測するために腫瘍のより正確な分子分類が提案されており、標準的なレジメンへの用量漸増や新しい抗腫瘍薬の組み込み、新しい治療の必要性など、CAR-T免疫細胞療法、チェックポイント阻害剤、分子標的阻害剤などのオプションを加えた個別のアプローチが必要です。
以前は分子療法では近づき難い病気と考えられていたTNBCは、最近、固有の分子TNBCサブタイピングと正確な分類と予後予測のために、新しい標的療法を組み込むための最も研究が活性化している分野となりました。特定のバイオマーカーによって分類されたサブタイプ・分子生物学的なバリエーションと、現在の化学療法、免疫療法、および標的療法の組み合わせにより、TNBCの治療に大きな進歩が達成されようとしている。
いくつかのREVIEW文献をまとめて、現在のトリプルネガティブ乳がんの治療動向を整理していきたいと思います。

虎の門病院
トリプルネガティブ乳がん(TNBC)について (作成中)
はじめに
トリプルネガティブ乳がん(TNBC)は、乳がん全体の15%程度を占めています。TNBCは、エストロゲンとプロゲステロンの受容体の免疫組織化学(IHC)による発現が1%以下で、HER2の過剰発現や増幅がないことが標準的な定義となっています。さらに、TNBCは通常、組織学的悪性度、増殖能が高く、増殖し、多くの壊死組織を伴っています。このタイプのがんは、40歳未満の女性、アフリカ系、ラテン系の女性、またはBRCA遺伝子(主にBRCA1遺伝子)の変異を有する女性に多く見られます。
TNBCの生物学的特性は、他の乳がんと比較して、たちが悪く、早期に再発し、遠隔転移を起こす傾向があります。TNBCの予後が悪いのは、主に標的治療法が確立されていないためです。化学療法に対する高い奏効率は、早期に耐性メカニズムが発現するため、時間的に長続きしません。早期のTNBCの相対的5年生存率は91%、局所進行期では65%、転移期では11%と報告されています。
<本文>
局所または局所進行TNBCの治療戦略は、CT(化学療法)、手術、放射線治療で構成される。治療法の選択は、原発巣の大きさ、位置、病変の数、リンパ節転移の有無、さらに年齢、閉経状態、一般的な健康状態、そして患者さんの希望に基づいて行われます。
閉経前の患者、特に若い患者さんでは、全身治療を開始する前に妊孕性温存技術(受精卵凍結など)の適応を考慮する必要があり、また患者の遺伝的な希望を考慮し、BRCA1/2検査も実施する必要がある。疾患の初期から、TNBCは全身性疾患であると考えるべきである。従来の画像診断技術では見えない微小転移の存在が乳がんの初期段階から存在すると考え、CTを用いて潜在的な病変の治癒を試みる必要がある。TNBCに効果があるとされている化学療法剤には、アントラサイクリン系薬剤(ドキソルビシンなど)、シクロホスファミド、タキサン系薬剤、プラチナ製剤、5-FU系薬剤、エリブリン、ゲムシタビンなどがあります。治療戦略としては、手術前に化学療法を投与する方法(NACT)と、手術後に化学療法を投与する二つの方法があります。
<化学療法は術前と術後のどちらが良いかという問題>
局所進行乳がんでは、術前化学療法(NACT)が標準的な治療法です。NACTの概念は、日常的な癌治療で採用されている抗腫瘍薬戦略に新たに加わったものです。NACTは、腫瘍の大きさ(特に2cm以上)を小さくすることで切除率を高め、乳房温存手術を可能にすること、微小転移を早期に制御すること、生体内での腫瘍の化学療法感受性や抵抗性を調べること、などの重要かつユニークな目的を持っています。NACTに対する反応は、長期的な反応の予測因子であり、5~10年の追跡調査で結果が得られる術後療法の研究とは異なり、短期間の追跡調査で予後の情報が得られます。NACTの欠点は、この治療法で腫瘍が進行した患者が外科手術が遅れるという問題です。
<続く>
Triple-negative breast cancer molecular subtyping and treatment progress. Yin L, Duan JJ, Bian XW, Yu SC. Breast Cancer Res. 2020 Jun 9;22(1):61. doi: 10.1186/s13058-020-01296-5. PMID: 32517735

The Okura Tokyo 2021年8月

The Okura Tokyo 9PM August 2021